|
|
|
А.Н. Стацкевич
А теперь вернемся в XVIII век, к тому вопросу, с которого берет свое начало физиология клетки — а именно, к вопросу о регуляции клеточного объема. Как мы уже знаем, вещества, проникающие в клетку, способны, вопреки мембранной логике, вызывать стойкое сжатие клетки в гипертонических растворах. Следовательно, механизм регуляции объема, предложенный Вант-Гоффом и Пфеффером, основанный на идее абсолютной непроницаемости мембраны для сахарозы, хлорида натрия и других осмотически активных веществ, оказался несостоятельным.
Ниже мы расскажем о новом механизме регуляции клеточного объема, основанном на ТМОПВ.
Одно время была весьма популярна теория бомбардировки Вант-Гоффа. В конце концов, было доказано, что она неверна. Как известно, осмотическое давление раствора нелетучего вещества связано с давлением пара растворителя следующим уравнением:
πV1 =RT In (р°/р),
где π — осмотическое давление, V1 — парциальный молярный объем нелетучего вещества в растворе (растворитель в данном случае — вода), R — газовая постоянная, Т — абсолютная температура, р° — давление насыщенного пара чистого растворителя, р — давление насыщенного пара растворителя над раствором. Крушение теории бомбардировки, установление связи между осмотическим давлением и давлением водяного пара означает, что механизм регуляции объема клетки необходимо искать в самой клеточной воде, а не в гипотетических свойствах мембраны, принимающей на себя удары молекул растворенных веществ.
Поскольку величина р°/р, обратная величине относительного давления пара (р/р°), является мерой активности воды, значит, осмотическая активность сахарозы, NaCl и других веществ объясняется тем, что они понижают активность воды, а не бомбардируют полупроницаемую клеточную мембрану. В 0,7% растворе NaCl мышечные волокна лягушки сохраняют свой обычный объем потому, что ионы Na+ и Cl-, концентрация каждого из которых составляет 0,118 моль/л, понижают давление пара над раствором до физиологического давления пара над живой тканью, а именно до 99,64% от давления пара над чистой водой.
При этом возникает новый вопрос: что внутри клеток играет роль противовеса ионам изотонического раствора NaCl или раствора Рингера, уравнивающего парциальное давление пара внутри- и внеклеточной среды?
Что снижает активность воды в клетке до активности воды раствора Рингера?
Когда в 1896 году Юлиус Катц сообщил, что мышцы позвоночных содержат большое количество ионов К+ и фосфатов, многие решили, что именно эти компоненты и являются главными «осмотически активными» составляющими клеток, в том числе и мышечных.
Однако рассмотренные нами ранее данные не оставляют сомнений в том, что основная масса клеточных ионов К+ и анионов (например, АТФ, креатинфосфата) адсорбированы (см. также у Ментен свидетельства локализованной адсорбции хлоридов и фосфатов в мышцах). Адсорбированные ионы не могут понижать активность воды, в отличие от свободных. Значит, эту роль в клетке выполняет что-то другое. И это «что-то», согласно ТАИ, — в первую очередь полноразвернутые внутриклеточные белки. Поляризуя и ориентируя воду внутри клетки, они понижают ее активность или, что то же, — относительное давление пара.
Следовательно, экстравертные модели, воспроизводящие свойства постулированных полноразвернутых белков клетки, адсорбирующие и поляризующие внутриклеточную воду, должны адсорбировать столько воды при физиологическом давлении пара, сколько это необходимо для достижения физиологического парциального давления пара, характерного для внутриклеточной среды.
Однако наши ожидания, что количество адсорбированной макромолекулами воды будет столь большим, как этого требует наш подход, резко противоречат традиционным взглядам на количественные характеристики гидратирования белков.
Как известно, мышца лягушки на 20% состоит из белков, и на 80% — из воды. Если вся эта вода адсорбируется всеми белками клетки, то один грамм сухого белка в среднем должен адсорбировать 4,0 грамма воды, что намного больше общепринятых значений — 0,2-0,3 грамма воды на грамм сухого белка.
Чтобы внести ясность, Лингу с сотрдниками пришлось опытным путем определить, сколько же воды адсорбируется на самом деле экстравертными моделями, такими как желатин и ПЭО, в состоянии диффузионного равновесия при физиологическом давлении пара. Как вы, вероятно, помните, Енё Эрнст уже предпринимал некоторые шаги в этом направлении, сравнивая сорбцию воды мышцами лягушки и желатином. Однако необходимо обратить внимание на то, что он и его коллеги работали при относительном давлении пара много ниже физиологического, так что их результаты мало нам помогут. А изучение сорбции воды при физиологическом давлении пара сопряжено с большими техническими трудностями.
Хотя исследование сорбции воды изолированными белками уже давно стало привычным делом, пределом относительного давления пара для большинства экспериментов остается лишь 95% насыщения. При этом в растворе Рингера (и в клетках лягушки, находящихся с ним в равновесии) относительное давление пара гораздо ближе к насыщению пара чистого растворителя и равно 99,64%. Несущественная, казалось бы, разница между давлением пара 95% и 99,64% (какие-то 4,64%) оказывается на самом деле весьма значительной для исследований такого рода. Так, при давлении пара 95% от насыщения равновесное содержание воды в мышечном волокне лягушки составляет лишь 0,88 грамм на грамм сухого веса против 4,0 грамм на грамм сухого веса при давлении пара над раствором Рингера — 99,64% от равновесного давлении пара чистой воды, то есть волокно обезвожено почти на 80%!
До выхода в 1987 году статьи Линга и Ху было известно лишь две публикации о гидратации биоматериалов при равновесном давлении пара чистой воды или при близких к этому пределу значениях. Имеются в виду опыты Спикмена с овечьей шерстью и другими материалами, опубликованные в 1944, а также опыты Юлиуса Катца на различных биоматериалах, опубликованные еще в 1919 году. Несмотря на огромную важность для физиологии таких экспериментов, немногие решались проводить их — очевидно, по причине медленного установления равенства давления пара между объектом и раствором с физиологическим равновесным давлением пара.
Действительно, опыты Юлиуса Катца продолжались месяцами, но и этого времени оказалось недостаточно. Линг и Ху показали, что даже по истечении 319 суток при относительном давлении пара 0,99858 от насыщения над чистым растворителем масса экстравертной модели — поливинилпирролидона (ПВП-360) — продолжала расти. Чтобы решить эту проблему, Линг и Ху предложили новый метод. Названный методом нулевой точки, он уменьшил длительность каждого опыта до 5 дней и позволил получить следующие данные:
При относительном давлении пара над раствором Рингера (0,9964) экстравертные модели ПЭО, ПЭГ-800, ПВП-360 и желатин сорбируют от 300 до 400 и более грамм воды на 100 грамм полимера или белка, что близко к физиологическим 400 граммам воды на 100 грамм белков мышц лягушки. Даже интровертные модели, такие, как нативный гемоглобин и бычий сывороточный альбумин, связывают в этих условиях от 90 до 150 грамм воды на 100 грамм белка, или 0,9-1,5 грамм воды на грамм белка, что значительно выше цифр, получивших распространение в литературе (0,2-0,3 г/г).
Ни в одном опыте на экстравертных или интровертных моделях in vitro не было сделано попыток выстроить молекулы белка или полимера параллельно друг другу, кроме эксперимента с ПВП. Остальные же полимеры и белки не были организованы параллельно, поэтому их состояние существенно отличалось от тех параллельно организованных полноразвернутых белков в клетках, существование которых постулирует ТМОПВ. Параллельная ориентация усиливает поляризацию воды и увеличивает число ее слоев, что доказано опытным путем. Именно это усиление поляризации и ориентации воды при упорядочении белков могло бы еще более приблизить содержание воды в экстравертных моделях (3,0-4,0 грамм на грамм белка или полимера) к содержанию воды в мышечных волокнах лягушки (4,0 грамма на грамм клеточного белка).
Подтвердив экспериментально предположение, что желатин и другие экстравертные модели способны оказывать существенное влияние на активность воды, приближая ее к активности воды, связанной постулируемыми полноразвернутыми экстравертными белками клеток, необходимо ответить на другой вопрос: можно ли на диализных мешках с растворами экстравертных моделей продемонстрировать in vitro набухание или сжатие, поместив их в раствор веществ, для которых их мембрана проницаема? Успех подобной демонстрации объяснил бы сразу два явления, которые оказалась не способна объяснить теория мембранного насоса:
1. Как клетки могут оставаться набухшими или сжавшимися в растворах ионов или иных веществ, для которых их мембрана полностью проницаема?
2. Почему вырезанные из мышцы сегменты набухают в гипотонических растворах также, как и неповрежденные клетки, хотя поверхности срезов лишены мембран?
Обратимое осмотическое сжатие содержимого диализных мешков с растворами экстравертных моделей, погруженных в концентрированные растворы веществ, для которых их мембрана полностью проницаема
Один из основных принципов мембранной теории гласит: лишь вещества, не проникающие через мембрану, способны вызвать стойкое сжатие клетки. Насонов, Айзенберг и Камнев это опровергли.
Еще раньше Мартин Фишер продемонстрировал набухание и сжатие кусочков желатина и фибрина, не обладающих мембраной.
ТМОПВ пошла еще дальше: она не только предложила физическое объяснение, почему желатин ведет себя подобно клетке, но и дала количественную молекулярную теорию равновесного объема как желатина, так и клетки.
Согласно ТМОПВ, стойкое сжатие клетки под действием концентрированного раствора вещества, проникающего в нее, является результатом сочетанного действия трех противоборствующих факторов:
1. Перманентная способность клеточных белков адсорбировать новые и новые слои воды, вызывая набухание.
2. Образование в клеточных белках внутри- и межмолекулярных солевых связей, сдерживающих набухание.
3. Низкая растворяющая способность внутриклеточной воды, благодаря которой в ней меньше осмотически активных веществ (Na+ и Cl- и других свободных компонентов), чем в среде. За счет этого фактора активность клеточной воды оказывается выше, чем снаружи (в гипертоническом растворе), и в результате она начинает оттекать во внешнюю среду — клетка начинает сжиматься. Согласно «правилу размера», можно предположить, что чем крупнее молекула основного осмолита (осмотически активного вещества), тем сильнее должна сжиматься клетка.
В экспериментах было показано, что растворимость сульфата или цитрата натрия в воде диализного мешка с ПВМЭ снижена. Как показали другие опыты, полиэтиленоксид (ПЭО) ведет себя точно так же. Если же переместить диализный мешок с ПЭО из раствора цитрата натрия одной концентрации (после установления диффузионного равновесия) в раствор более низкой или более высокой концентрации, содержимое мешка соответственно увеличится в объеме или уменьшится, и будет оставаться в таком состоянии, несмотря на то, что его мембрана полностью проницаема для цитрата натрия (рис.). Следовательно, ссылка на непроницаемость мембраны для цитрата натрия не может служить объяснением стойкого сжатия содержимого мешка, которое вызывает более концентрированный омывающий раствор этой соли. Это противоречит мембранной теории, настаивающей в таких случаях на непроницаемости мембраны, зато полностью соответствует поздним наблюдениям Хёфлера, а также Насонова, Айзенберга и Камнева.
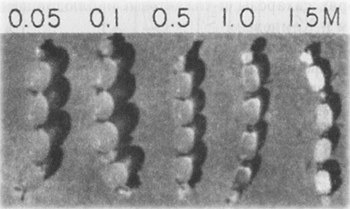 |
Стойкое обратимое набухание и сжатие содержимого диализных мешков, заполненных раствором полиэтиленоксида (ПЭО) с начальной концентрацией 30%, после инкубации в растворах цитрата натрия (концентрации указаны на рис.). ПЭО — это нейтральный полимер и его набухание и сжатие нельзя объяснить электростатическими взаимодействиями, например, эффектом Доннана (по Лингу). |
Все, что делает мембрана диализного мешка — препятствует выходу ПЭО в окружающую среду. Способностью обратимо набухать и сжиматься обладали все исследованные экстравертные модели, в частности, желатин, а также денатурированный мочевиной и NaOH бычий сывороточный альбумин. В других экспериментах показано, что незаряженные вещества — D-глюкоза и D-сорбит — способны влиять на объем растворов экстравертных моделей так же, как и цитрат натрия. Теперь, когда мы располагаем обширными (хотя и косвенными) свидетельствами тому, что некоторые или все белки мышц лягушки, эритроцитов и, судя по всему, остальных клеток находятся в полноразвернутой конформации, мы можем объяснить осмотическое сжатие мышц лягушки в концентрированных растворах сахарозы и галактозы, наблюдавшееся Насоновым, Айзенбергом и Камневым.
В отличие от мышц и экстравертных моделей, диализные мешки с раствором нашивного бычьего сывороточного альбумина — интровертной модели — в концентрированных и разбавленных растворах цитрата натрия своего объема не меняют, что также полностью согласуется с ТМОПВ.
До сих пор мы рассматривали то, что традиционно называется осмотическим набуханием и сжатием, и как при этом взаимодействуют два из трех вышеупомянутых факторов — первый и третий. Позднее мы расскажем, как можно влиять на объем клетки воздействием на фактор номер два — сдерживающую силу солевых связей.
Как уже говорилось, ТМОПВ позволила Лингу вывести уравнение равновесного связывания воды клеткой, позволяющее рассчитывать содержание воды в ней в граммах на 100 грамм сухого белка. Это уравнение объяснило наблюдения Насонова, Айзенберга и Камнева, согласно которым вещества, проникающие через мембрану способны вызывать сжатие клеток и удерживать их в этом состоянии. Оно стало хорошим аналитическим выражением выявленных эмпирических зависимостей, описывающим равновесное содержание воды в клетках, погруженных в растворы проникающих через мембрану веществ с различными значениями коэффициента распределения q. В больших концентрациях вещества с низким значением коэффициента q, такие как сахароза и NaCl, вызывают сжатие клетки, заставляя воду выходить из нее. Вещества же, подобные этиленгликолю, для которых характерны коэффициенты q, близкие к 1, напротив, заставляют клетку поглощать воду, в результате чего ее вес становится больше, чем исходный в растворе Рингера или тканевой жидкости.
Оценив принципиальные положения имеющихся альтернатив мембранной теории, — от теории Бенджамина Мура до ТФЗЛ и ТМОПВ, — продолжим наш разговор о теории натриевого насоса и о мнимых мембранных насосах вообще.
Подготовлена с использованием материалов книги Гильберта Линга "Физическая теория живой клетки"
А.Н. Стацкевич, Осмысление пройденного 6. Осмотическая регуляция объема клетки // «Академия Тринитаризма», М.,
|
|