|
|
|
Никитин А.В.
Мы продолжаем разбираться с процессом считывания информации с РНК. Начатый ранее в статьях [5,6] поиск триплетов на РНК привел нас к рибосомам – автоматам для сборки белка по информации РНК. Оказалось, что триплеты на РНК находит и считывает только она, рибосома.
Как же рибосома находит триплеты на РНК?
Ответ оказался сложным и неожиданным. В качестве основы для поиска были взяты статьи А.С. Спирина [1-4]. Очень уж четким и продуманным видится в них понимание работы рибосомы.
Нам, дилетантам сложно разбираться в биохимических реакциях и хитросплетениях научного языка. И потому опять будут большие цитаты, для четкого понимания авторского изложения, без купюр. Иначе запутаемся же…
«Скольжение» пропускаем…
Начнем с самого начала. С того момента, когда часть рибосомы «села» на РНК. Части рибосомы собираются в общую конструкцию прямо на РНК.
Итак, рибосома села на РНК, вернее, её малая субчастица…
Трансляция начинается с того, что мРНК, синтезируемая на ДНК в качестве копии одной из двух цепей последней, связывается с рибосомной частицей. При этом рибосомная частица (у прокариот прямо и непосредственно, а у эукариот после некоторого скольжения вдоль некодирующей части мРНК) специфически взаимодействует с началом кодирующей нуклеотидной последовательности мРНК. [3]
О трансляции мы еще поговорим, а пока отметим одно очень важное событие. Рибосома, перед началом трансляции на транслируемых областях мРНК проходит множество триплетов «скользя» по ним. Насколько можно понять, вопрос: что рибосома в этот момент делает, еще никого не волновал. Скользит…
А ведь этот процесс, как можно теперь понять, очень важный. Рибосома как-то читает информацию. Но автор сосредоточился на трансляции. Пойдем за ним.
Инициация, это – начало считывания.
Да, автор настаивает на этом. Он считает, что: «Инициация также и начало считывания мРНК, которое должно всегда осуществляться со строго фиксированной определенной точки матричного полинуклеотида. Это начало считывания - никогда не начало полинуклеотидной цепи мРНК (то есть не ее 5'-конец), а всегда находится несколько или даже много отступя от начала цепи. Следовательно, требуется механизм точного узнавания первого кодона на мРНК, чтобы начать синтез полипептида именно с его первого аминокислотного остатка». [2]
То есть, рибосома как-то находит инициирующий кодон без считывания и опознавания его кода. С другой стороны, автор отмечает:
«Узнавание рибосомой стартовой точки трансляции мРНК должно быть очень точным еще по одной причине. Рибосома читает кодоны мРНК строго последовательно, триплет за триплетом, и это устанавливает так называемую рамку или фазу считывания. Никаких "пробелов" или "запятых" между триплетами нет: их правильное считывание определяется только изначально заданной триплетной рамкой. Поэтому начало потриплетного считывания одним нуклеотидом раньше или одним нуклеотидом позже привело бы к сдвигу рамки, а тем самым не только к утрате первой аминокислоты пептида, но и к полной бессмысленности всей остальной аминокислотной последовательности». [2]
Ну понятно, «тут читаем, тут – не читаем, а тут – рыбу заворачивали…», как-то так.
Как бы ни было, а надо найти стартовый кодон очень точно. От этого зависит вся дальнейшая трансляция белка. Ошибиться нельзя.
«Диссоциация рибосомы на составляющие ее субчастицы, малую и большую…, является необходимой предпосылкой для инициации трансляции». [2] Рис. 1. Схематическое представление двух способов выхода рибосомной частицы (малой рибосомной субчастицы) на стартовую позицию трансляции мРНК: способ терминальной инициации, свойственный эукариотам (вверху), и способ внутренней инициации, используемый в основном прокариотами (внизу)
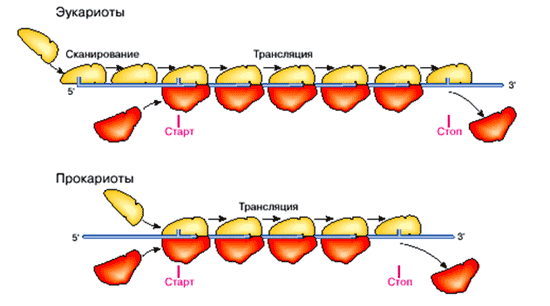
Отмечаем, что во внутриклеточной жидкости субчастицы рибосомы плавают отдельно. На цепь мРНК садится только малая субчастица. Она и производит «сканирование» мРНК до стартового триплета. Это подтверждает и автор:
«Именно свободная малая рибосомная субчастица, а не целая рибосома вовлекается в дальнейший процесс инициации». [2]
И только при нахождении стартового триплета малая субчастица рибосомы начинает активные действия:
«Дальнейшие события инициации могут разыгрываться в двух направлениях: либо нативная малая субчастица сначала садится на мРНК, а затем связывает инициаторную аминоацил-тРНК в комплексе с IF2 и ГТФ …, либо к малой субчастице сначала присоединяется инициаторная аминоацил-тРНК с IF2 и ГТФ, а затем этот комплекс ассоциирует с мРНК... Считается, что оба пути могут сосуществовать в клетке или бесклеточной системе трансляции. В обоих случаях достигается один и тот же результат: образуется так называемый инициаторный комплекс, состоящий из малой рибосомной субчастицы, мРНК, инициаторной аминоацил-тРНК и инициаторных факторов». [2]
Действительно, надо уточнить, порядок действий тут важен:
«Считается, что эукариотическая малая субчастица взаимодействует с инициаторной аминоацил-тРНК преимущественно до ассоциации с мРНК, …. Связавшись с 5'-концом мРНК и неся на себе инициаторную аминоацил-тРНК и факторы инициации, малая рибосомная субчастица начинает двигаться от 5'-конца по направлению к 3'-концу (вниз по течению) и сканировать нуклеотидную последовательность мРНК, потребляя энергию АТФ». [2] «Когда сканирующая рибосомная частица встречается с инициаторным кодоном, антикодон инициаторной аминоацил-тРНК взаимодействует с ним, и сканирование прекращается: рибосомная частица нашла начало кодирующей последовательности мРНК». [2]
Очень важное уточнение:
«В качестве инициирующего кодона в большинстве случаев выступает триплет AUG; у эукариот он практически единственный инициаторный кодон, а у прокариот 90% всех кодирующих последовательностей начинаются с него. Однако некоторая часть прокариотических мРНК инициирует трансляцию на других триплетах - GUG, реже UUG и совсем редко на некоторых других. Очевидно, что у прокариот способность некоторых триплетов быть инициирующими определяется их положением в инициаторном, или рибосомосвязывающем участке мРНК. Эти же триплеты, когда они встречаются в кодирующей последовательности в ходе элонгации, кодируют ту или иную аминокислоту: AUG - метионин, GUG - валин, UUG – лейцин». [2]
Теперь фиксируем начальную ситуацию при начале инициации:
«Итак …малая рибосомная субчастица оказывается сидящей на инициирующем кодоне - стартовом триплете кодирующей последовательности мРНК со связанной инициаторной метионил-тРНК, своим антикодоном взаимодействующей с инициирующим кодоном, и с набором факторов инициации»; [2]
И вот наконец:
«На этом этапе в процесс включается свободная большая рибосомная субчастица (рис. 4, шаг 4 ). Она, ассоциируя с малой субчастицей и взаимодействуя со связанным IF2, наводит ГТФазную активность на IF2, в результате чего ГТФ гидролизуется на ГДФ и ортофосфат, сродство IF2 к инициаторной метионил-тРНК теряется и IF2 с ГДФ легко вытесняются из рибосомы. При этом инициаторная метионил-тРНК после ухода IF2 оказывается в Р-участке рибосомы. Большая субчастица при ассоциации с малой субчастицей вытесняет и все другие факторы инициации, включая IF3. В итоге образуется полная 70S (у прокариот) или 80S (у эукариот) рибосома с Р-участком, занятым инициаторной метионил-тРНК, и с вакантным А-участком». [2]
Скажем проще, малая субчастица после посадки на мРНК отлавливает тРНК с нужным кодом стартового кодона МЕТ и закрепляет на себе, это происходит на участке А. Затем, действуя кодом тРНК, как пробным эталоном для поиска, она находит стартовый кодон на мРНК. Наконец, в процессе сканирования очередной «замочек и ключик» подошли друг к другу. Антикодон тРНК и стартовый кодон мРНК устойчиво соединились.
Происходит первый цикл трансляции. Малая субчастица качнулась в принудительном порядке и переместила стартовую тРНК с участка А на участок Р, освобождая место для следующей тРНК…
«За этим завершающим шагом процесса инициации начинаются образование и элонгация пептида: вакантный А-участок принимает первую элонгаторную аминоацил-тРНК в комплексе с фактором элонгации EF1 и ГТФ, после чего ГТФ гидролизуется, EF1 с ГДФ уходят из рибосомы, а элонгаторная аминоацил-тРНК, связанная в А-участке, остается бок о бок с инициаторной метионил-тРНК, связанной в Р-участке. В результате аминоацил-тРНК получает возможность реагировать с инициаторной метионил-тРНК в реакции транспептидации, катализируемой большой субчастицей рибосомы»… [2]
Катализатором, видимо, является … движение большой субчастицы в процессе трансляции и сжатие двух тРНК на участке Р.
Инициация трансляции состоялась. И автор указывает на это:
«После того как произошла инициация трансляции, рибосома осуществляет прочный комплементарный контакт связанных с ней молекул
Ладно. Пока пойдем дальше.
А теперь – трансляция… «Этап связывания мРНК с рибосомной частицей и нескольких последующих событий, приводящих к образованию первой пептидной связи, называется инициацией трансляции. Вслед за инициацией рибосома последовательно "читает" цепочку мРНК по тройкам ( Наконец, достигнув специального нуклеотидного триплета - «Эпицикл трансляции, включающий инициацию, элонгацию и терминацию, схематически представлен на рис. 2. Рис. 2. Эпицикл трансляции: 1) свободная рибосомная частица ассоциирует с мРНК у начала ее кодирующей последовательности нуклеотидов и начинает трансляцию на специальном инициирующем кодоне, с участием специальной инициаторной тРНК (инициация трансляции); 2) затем считывает кодирующую последовательность нуклеотидов по триплетам (кодонам) в направлении от 5'-конца к 3'-концу и соответственно наращивает полипептидную цепь по одной аминокислоте, последовательно удлиняя ее С-конец (элонгация); 3) и, дойдя до специального стоп-триплета (терминирующего кодона), прекращает трансляцию и освобождает законченную полипептидную цепь белка (терминация трансляции). Рибосомные частицы, закончившие трансляцию и диссоциировавшие от мРНК, снова готовы инициировать трансляцию и войти в эпицикл». [3] «Механизм потриплетного сканирования мРНК в ходе элонгации предполагает участие молекул тРНК, которые взаимодействуют прежде всего с малой рибосомной субчастицей. Малая субчастица в составе полной транслирующей рибосомы имеет два тРНК-связывающих участка, обозначаемых как аминоацил-тРНК-связывающий участок (А-участок) и пептидил-тРНК-связывающий участок (Р-участок)». [3]
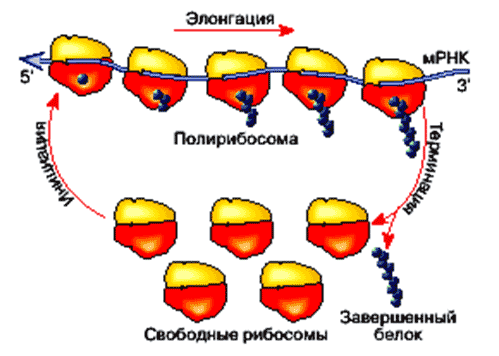
Таким образом, все активные зоны для проведения трансляции сосредоточены на малой субчастице рибосомы. Большая субчастица пока рассматривается только как платформа.
«На этапе элонгации Р-участок всегда занят остатком тРНК. Рассмотрение элементарного акта элонгации удобно начать с момента, когда Р-участок занят молекулой пептидил-тРНК (тРНК, несущая растущую полипептидную цепь), а А-участок вакантен и содержит лишь некий нуклеотидный триплет (кодон) мРНК, пока не взаимодействующий ни с каким триплетом (антикодоном) тРНК (рис. 3, состояние I). Такая рибосома готова (компетентна) связать аминоацил-тРНК, антикодон которой комплементарен триплету (кодону), установленному в А-участке. При наличии около рибосомы такой аминоацил-тРНК происходит первый шаг элементарного элонгационного цикла - кодонспецифическое связывание аминоацил-тРНК с А-участком. Теперь рибосома несет "старую" пептидил-тРНК в Р-участке и новоявленную аминоацил-тРНК в А-участке, которые расположены рядом, бок о бок (рис. 3, состояние II ). Следовательно, в результате кодон-антикодонового взаимодействия мРНК с тРНК на малой субчастице рибосомы произошло декодирование триплета мРНК: именно тот аминокислотный остаток, который был привешен к тРНК с комплементарным антикодоном, оказался в рибосоме». [3] Рис. 3. Элементарный элонгационный цикл рибосомы, в результате которого прочитывается один «В каждый данный момент в ходе элонгации рибосома сидит на участке кодирующей последовательности Рибосома (ее пептидилтрансферазный центр на большой субчастице) катализирует реакцию транспептидации между этими двумя субстратами рибосомы - пептидил-тРНК и аминоацил-тРНК: пептидильный остаток переносится от "своей" тРНК на Теперь в Р-участке осталась деацилированная тРНК, а в А-участке помещается остаток тРНК удлиненной пептидил-тРНК (состояние III ). Следующий за этим акт транслокации состоит в том, что деацилированная тРНК выталкивается из Р-участка, а пептидил-тРНК (ее остаток тРНК) перемещается вместе со связанным с ней кодоном мРНК из А-участка в Р-участок (шаг 3 ). В итоге А-участок освобождается, и в нем устанавливается следующий кодон мРНК. Цикл завершился. Повторение таких циклов по числу кодонов мРНК создает полный процесс элонгации. Следует отметить, что шаг 1 (связывание аминоацил-тРНК) катализируется белком - фактором элонгации EF1 - с участием
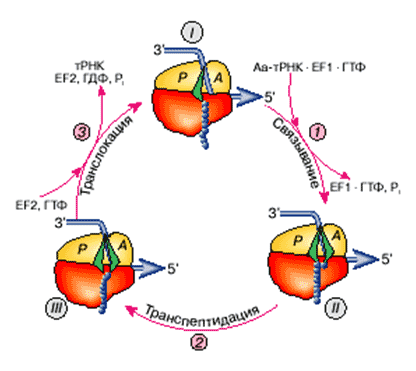
Что-то очень сложно. Начнем разбираться. Итак: А – свободен. Р- занят. В нем тРНК с полипетидной цепью белка.
Первый шаг элонгационного цикла - кодонспецифическое связывание аминоацил-тРНК с А-участком.
- Кодон мРНК связался в антикодоном тРНК на участке «А».
- тРНК «А» и тРНК «Р» оказались «бок о бок»
Второй шаг элементарного элонгационного цикла - транспептидация
Новая тРНК на участке «А». Участок «Р» все еще занимает тРНК, уже передавшая полипетид, как эстафетную палочку тРНК на участке «А». Такое состояние называется претранслокационным.
Третий шаг элонгационного цикла – транслокация.
«Цикл завершился, приведя к образованию одной пептидной связи и соответствующему удлинению растущего полипептида на одну аминокислоту, с одной стороны, и к прочтению одного кодона мРНК и перемещению мРНК на один триплет - с другой. Повторение таких элементарных циклов и создает процесс элонгации». [3]
Из сказанного можно установить только ход событий. Понятно, что происходит, но непонятно – как? И, похоже, что автор подумал точно так же. Потому, что на этом он не остановился, а продолжил свое описание этого процесса. Снова, да ладом…
В следующем разделе он снова дает тот же рисунок и повторяет весь процесс.
Но мы не будем повторять уже пройденное. Сосредоточимся на новых фактах: «Работа рибосомы в качестве "лентопротяжного механизма" (последовательное прочитывание цепи мРНК от одного конца к другому) в ходе элонгации (см. рис. 2) и ее способность перебрасывать сравнительно большие молекулярные массы (молекулы тРНК) из одного участка в другой в каждом элементарном элонгационном цикле (см. рис. 3, шаг 3 ) предполагают ее механическую подвижность. Взаимная подвижность двух рибосомных субчастиц может быть основным видом крупноблочной подвижности рибосомы в ходе работы, и имеются экспериментальные свидетельства в пользу такой подвижности. Кроме того, существуют указания на подвижность "головки" малой рибосомной субчастицы относительно ее "тела" и на подвижность палочкообразного бокового выступа большой рибосомной субчастицы». [4]
Таким образом, далее процесс должен идти в условиях фиксированных движений как самой рибосомы, так её части – малой рибосомной субчастицы, и еще - «головки». И еще «палочкообразного бокового выступа».
«Однако со структурно-молекулярной точки зрения переходы между состоянием I и состоянием II (кодонзависимое связывание аминоацил-тРНК) и особенно между состоянием III и состоянием I (транслокация) кажутся затруднительными без промежуточных состояний, где рибосомные лиганды имели бы некоторую свободу внутририбосомных перемещений или были бы частично делокализованы. Необходимость промежуточных состояний вытекает из простого соображения: такие большие (с молекулярной точки зрения) лиганды, как тРНК, должны связываться с рибосомой несколькими контактными точками своей поверхности (многоцентровое связывание), а одновременное образование или разрыв многих контактов должны сопровождаться большими кинетическими (энергетическими) барьерами, делающими такие процессы крайне медленными (маловероятными)». [4]
Замечание вполне справедливое. Разговор идет о состояниях: кодонспецифическое связывание, транспептидация, транслокация. Что же добавляется?
Рис. 4. Модель динамической работы рибосомы в элонгационном цикле (на данной схеме "головки" обеих рибосомных субчастиц обращены к зрителю). «Модель постулирует, что две рибосомные субчастицы подвижно соединены друг с другом и способны к некоторому раздвиганию (размыканию) и сдвиганию (смыканию). Размыкание открывает функциональные центры на контактирующих поверхностях субчастиц, такие, как А-участок для приема аминоацил-тРНК, и способствует перемещению лигандов, например в ходе транслокации. Смыкание субчастиц запирает лиганды внутри рибосомы и приводит в тесный контакт субстраты для реакции транспептидации. Предполагается, что размыкание индуцируется факторами элонгации с ГТФ, а гидролиз ГТФ и уход факторов с рибосомы позволяют ей снова сомкнуться». [4]
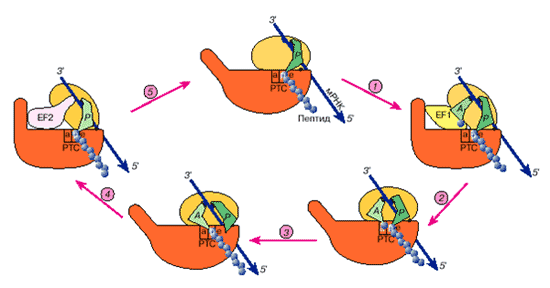
Добавляются операции смыкания и размыкания частей рибосомы. На рисунке представлено рассмотрение элонгационного цикла с точки зрения модели смыкания-размыкания:
- связывание аминоацил-тРНК с рибосомой требует размыкания, и фактор элонгации EF1 с ГТФ призван "открыть" рибосому;
- после расщепления ГТФ фактор элонгации EF1 покидает рибосому, а аминоацильный конец аминоацил-тРНК взаимодействует с пептидилтрансферазным центром большой субчастицы и тем самым способствует смыканию субчастиц и запиранию рибосомы;
- реакция транспептидации происходит в "закрытой" рибосоме между тесно сближенными группами двух субстратов - пептидил-тРНК и аминоацил-тРНК;
- размыкание претранслокационной рибосомы промотируется фактором элонгации EF2 с ГТФ, что приводит к выходу деацилированной тРНК и смещению остатка тРНК молекулы пептидил-тРНК вместе с мРНК;
- гидролиз ГТФ и как следствие уход фактора элонгации EF2 снова дает возможность рибосоме сомкнуться.
Таким образом, транслирующая рибосома в ходе элонгационного цикла осциллирует между сомкнутым и разомкнутым состояниями. [4]
Вот тут остановимся. Еще раз пройдемся по операциям трансляции, теперь уже с точки зрения механики. Посмотрим на рис.4.
Что значит, рибосома сомкнута? Потому, что малая субчастица лежит на большой. Да, лежит, но…, надо обратить внимание на положение мРНК. Что мы видим?
Оказывается, на рис.4. мРНК проходит … с другой стороны от сомкнутого участка малой и большой субчастиц. И в тот момент, когда субчастицы сомкнуты, мРНК, как раз свободна. И участки А и Р открыты.
Да, на рис.3. состояния рибосомы, оказывается, показаны совершенно правильно, а движения малой субчастицы поняты не совсем верно. Попробуем еще раз, ориентируясь на положение мРНК по рис.4.:
- Рибосома открыта . (это состояние 5 на рис.4.) Зона А пуста. Подходит тРНК с нужным антикодоном и входит в зону А.
- Закрытие рибосомы сжимает и фиксирует две тРНК. Старую и новую. В зоне транспептизации, т.е. присоединения нового пептида к полипептидной цепи. Это состояние 1 на рис.4. Да, на сжатие нужна энергия и она есть.
- Рибосома закрыта . В этом состоянии новая тРНК, находящаяся в зоне А, перевешивает на себя всю цепь белка, освобождая старую тРНК в зоне Р.
- Рибосома отрывается . Это состояния 2 и 3 на рис.4. Сбрасывается пустая тРНК из зоны Р. На освободившееся место встала тРНК из зоны А, а вместе с ней вдоль рибосомы продвинулась и вся цепь мРНК. Но, скорее всего, двигается по мРНК рибосома…, она все же легче, чем вся цепь мРНК вместе с еще и другими рибосомами, навешанными на неё.
- Цикл работы рибосомы завершен.
«… на каждое смыкание-размыкание рибосомы расходуется одна молекула ГТФ. Так как в каждом элонгационном цикле рибосома смыкается-размыкается дважды, то две молекулы ГТФ расходуются на каждый цикл. Это есть энергетическая плата за эффективное (быстрое и надежное) функционирование рибосомы как молекулярной машины». [4]
Но автор утверждает, что за один эпизод трансляции рибосома делает два «смыкания-размыкания». Где же второе «смыкание-размыкание»?
И еще. Малая субчастица открывается и закрывается. А что же тогда протягивает всю мРНК вместе с тРНК на участках А и Р вдоль большой субчастицы?
Причем протягивает очень точно. На один триплет. Мы забыли о «головке». Это очень важное и очень фиксированное движение видимо производит она. Но автор, хоть и говорит о «лентопротяжном механизме», об этом движении – ни слова…, а надо бы.
Как мне кажется, продольное движение мРНК вдоль большой субчастицы происходит при сжатии рибосомы. Представим, как это происходит.
Цикл начинается. Малая субчастица с подвижной головкой «размыкается». Головка, как наклонный рычаг -толкатель двигает мРНК и участки А и Р, а с ними и зафиксированные тРНК вдоль большой субчастицы точно на один триплет. Это продольное движение.
Движение мРНК вместе присоединенными к ней старой и новой тРНК приводит к тому, что новая тРНК, переходящая из участка А в участок Р, сначала прижимается к старой тРНК до степени, достаточной для реакции транспептизации, а потом и выталкивает старую тРНК дальше, за пределы участка Р. Тут она больше не нужна. А её место занимает оставшаяся тРНК с полипептидной цепью. И весь этот процесс идет при движении мРНК. Головка малой субчастицы двигается до упора – фиксации новой тРНК в зоне участка Р. Старая тРНК, уже отдавшая свой груз еще держится на мРНК и может служить стопором и дополнительной точкой фиксации мРНК при отрывании рибосомы. Хотя,… это уже мои домыслы.
Теперь смотрим, что получилось.
Малая субчастица замкнута. мРНК надежно зафиксирована двумя сцепленными с ней тРНК( одна в зоне участка Р, вторая за пределами активных зон, зажата замкнутой малой субчастицей и большой субчастицей рибосомы. И освободившаяся зона на участке А открыта для новой тРНК. РНКМмМ МММИИИ
И вот если учесть, что это второй возвратно-поступательный цикл движения в работе рибосомы, а на это тратится энергия, то за один рабочий такт тратится две молекулы ГТФ. Может быть так?
Но не только механические перемещения тРНК и мРНК требуют много энергии. Кажется, тут все выглядит сложнее: «Для чего же тогда потребляется ГТФ, да еще и по две молекулы на элонгационный цикл»? [4] «Это прямая атака молекулы воды на пирофосфатную связь ГТФ, и освобождаемая свободная энергия гидролиза полностью диссипирует в тепло». [4]
Ну вот, только что сам же автор нам показал, куда расходуется энергия ГТФ, и вдруг такой вывод…
Не просто на тепло, а на механическую работу. Большую работу.
Но, читаем дальше:
«Вместе с тем участие факторов элонгации и катализируемый ими гидролиз ГТФ очень сильно (на несколько порядков) увеличивает скорость элонгации. Это позволяет думать, что главная роль гидролиза ГТФ в элонгационном цикле чисто каталитическая, то есть кинетическая, а не термодинамическая». [4] «В случае катализа конформационных превращений, каковой наблюдается в элонгационном цикле при EF1-промотируемом связывании аминоацил-тРНК и EF2-промотируемой транслокации …, ситуация иная. Здесь, очевидно, белок-катализатор (EF1 или EF2) тоже имеет сродство к переходному конформационному состоянию рибосомы и тем самым за счет этой энергии взаимодействия фиксирует его. Далее рибосоме надо выйти из этого комплекса, чтобы "упасть" в следующее (продуктивное) состояние. Это было бы невозможно - комплекс оказался бы ловушкой, тупиком, - если бы не участие ГТФ». [4] «…Следовательно, именно фактор элонгации с лигандом ГТФ фиксирует переходное конформационное состояние рибосомы. Но посадка фактора на рибосому индуцирует ГТФазную активность фактора, ГТФ гидролизуется, и как следствие фактор теряет сродство к рибосоме и уходит. Рибосома "падает с барьера" в термодинамически устойчивое состояние». [4] «Таким образом, прямой гидролиз ГТФ представляется необходимым для "энзиматического" (фактор-промотируемого) катализа нековалентных конформационных переходов в элонгационном цикле». [4] Основная роль этого гидролиза - разрушение лиганда, обеспечивающего сродство катализатора к переходному конформационному состоянию, чтобы дать возможность выйти из этого промежуточного комплекса и перейти к следующему - продуктивному – состоянию». [4]
Как сложно. А попроще: ГТФ помогает рибосоме совершать механическую работу, чтобы открывать и закрывать верхнюю субчастицу. Это и понимается как «барьерные переходы» с одного энергетического уровня на другой. Другого назначения не находит и автор.
И наконец, завершающий этап трансляции:
«Сканируя цепь мРНК по триплетам и соответственно удлиняя полипептидную цепь, транслирующая рибосома доходит до конца кодирующей последовательности и встречается с одним из трех триплетов, не кодирующих аминокислоты и обозначаемых как стоп-кодоны, или кодоны терминации - UAG, UAA или UGA (раньше их называли незначащими, или бессмысленными, триплетами). В результате завершающей транслокации полипептидил-тРНК оказывается связанной с последним значащим триплетом в Р-участке рибосоме, а в А-участке устанавливается кодон терминации…» [1] «В клетке нет аминоацил-тРНК, способных комплементарно связываться с терминирующим кодоном, и потому А-участок не заполняется обычным акцепторным субстратом, каковым является аминоацил-тРНК. Вместо этого в дело вступают специальные белки, называемые
Таким образом, вместо тРНК в момент нахождения терминирующего кодона рибосома использует белки – факторы терминации (RF1, RF2, RF3) в зависимости от найденного терминирующего кодона. Как-то запутано, ну, хоть так…
«Таким образом, связь между синтезированным полипептидом (его С-концом) и тРНК гидролизуется и полипептид уже не удерживается в рибосоме и освобождается в раствор в виде готового белка». [1]
Вот и всё. Трансляция закончена. «Заключительным актом терминации является выход деацилированной тРНК из Р-участка и диссоциация рибосомы на субчастицы. Диссоциация происходит спонтанно вследствие ослабления связи между двумя рибосомными субчастицами в отсутствие лигандов (пептидил-тРНК и аминоацил-тРНК), и у бактерий может значительно ускоряться под действием специального белка, называемого фактором освобождения рибосом». [1]
Субчастицы рибосомы снова разошлись.
«После диссоциации терминировавшей рибосомы на субчастицы малая субчастица не обязательно покидает мРНК: она может задержаться на ней и в случае полицистронных мРНК у прокариот … проскользнуть по цепи мРНК до начала следующей кодирующей последовательности и инициировать новую трансляцию (реинициация). [1]
На цепочке мРНК опять осталась только малая субчастица. Она дойдет до конца цепи и сойдет с неё. И пойдет искать следующую цепочку мРНК для проведения трансляции белка. «На самом деле тенденция к диссоциации рибосом наблюдается сразу после того, как рибосома дочитала кодирующую последовательность мРНК и терминировала - окончила синтез полипептида. После терминации рибосомные субчастицы становятся слабо ассоциированными друг с другом (и с мРНК) и скорее находятся в динамическом равновесии с ассоциированной формой, чем в прочной ассоциации …. Специальные белки вмешиваются в это равновесие таким образом, что, связываясь со свободной малой рибосомной субчастицей (30S в случае прокариот или 40S в случае эукариот), препятствуют ее реассоциации с большой субчастицей и тем самым сдвигают равновесие в сторону диссоциации. [2]
А в цитоплазме клетки поддерживается равновесие свободных субчастиц: «Так как малая субчастица до инициации слабо удерживается на мРНК, то, если ей нечего реинициировать на этой же цепи мРНК, она скоро соскочит с нее и окажется среди пула свободных субчастиц цитоплазмы, готовых к инициации трансляции других мРНК». [1]
Понятно…
С точки зрения механики…
Разобравшись с процессом трансляции можно предположить, что основным аппаратом считывания информации РНК является малая субчастица рибосомы. Большая субчастица нужна только на этапе трансляции. В момент начала трансляции она садится на свое место, соединяясь с малой субчастицей в единый комплекс, а после окончания трансляции отсоединяется и тут же уходит. А малая остается. И продолжает движение по мРНК, используя энергию АТФ.
А теперь еще раз посмотрим на процесс трансляции белка с точки зрения механики. Что же происходит?
Малая субчастица рибосомы «садится» на цепочку РНК где-то в районе за КЭП структурой на участке 5' стандартной мРНК [5], прошедшей процессинг и готовой к трансляции. Малая субчастица скользит по мРНК до появления «СТАРТ – кодона» AUG.
И останавливается.
Тут происходит сразу несколько действий:
- Должна появиться тРНК, несущая аминокислоту МЕТ и закрепиться на участке А малой субчастицы рибосомы.
- Антикодон тРНК соединяется с мРНК на участке А рибосомы и фиксирует стартовый триплет.
- Должна появиться большая субчастица и соединиться с малой.
- Должен появиться и «мускул» - белок, создающий движение субчастиц.
Инициация состоялась. Наконец-то рибосома собралась и готова к трансляции.
Далее рибосома начинает работать как высокоскоростной автомат. Две сцепленные где-то по линии прохождения мРНК субчастицы рибосомы начинают работать, как степлер, дырокол или ручная швейная машинка, сближая и снова разводя незакрепленные части под действием «мускульного» белка. «Основанием» служит большая субчастица, а рычагом или ручкой – малая. «Рычаг» с силой прижимает мРНК к большой субчастице и сдвигает её в сторону Р-участка на один триплет. При этом тРНК, находящаяся там сначала зажимается надвигающейся на неё тРНК из А-участка, а затем и просто выбрасывается за пределы зоны трансляции.
Но при сжатии двух тРНК и происходит самый важный этап – трансляция белка. Надвигающаяся из участка А тРНК своим пептидом захватывает всю полипептидную цепочку, удлиняя таким образом цепочку сборки белка, а «пустая» уже тРНК, отдавшая эту цепь, выдавливается за пределы зоны трансляции. И всё это происходит, видимо, за один рабочий такт сжатия «мускульного» белка рибосомы.
Со стороны это должно смотреться, как мидия или устрица, висящая на цепи мРНК в окружении мелких «мушек» - тРНК, и хлопающая половинками своей раковины с большой скоростью…, а из места сочленения половинок раковины быстро растет цепочка белковой молекулы, как нитка разноцветных бус. Вот одна нитка бус готова и отделилась от рибосомы, но рибосома тут же начинает сборку новой нитки…, а таких рибосом на цепи мРНК – десятки…
И вот работающая рибосома доходит до последнего СТОП – кодона. Всё. Конец трансляции.
Теперь происходит обратный процесс. Разборка автомата на составляющие. Уходит большая субчастица. На мРНК опять остается только малая субчастица рибосомы. Она продолжает движение, может быть, за счет того же «мускульного» белка, не знаю, но двигается она до конца мРНК. И сходит только в конце зоны 3'…
С точки зрения механики работа рибосомы при трансляции белка почти понятна, если не считать биохимических сложностей протекающих реакций. И все же..
Вопросы остаются…
Как хорошо у нас повелось. Всё что мы пока не знаем, мы называем «мусором», ненужным и непонятным. «Мусором» до недавнего времени считались стоп-кодоны, «мусором» считается нетранслируемая часть мРНК. Хорошо и удобно. «Мусор», и всё.
Никаких проблем и вопросов.
Зачем этот «мусор» включен в мРНК? Зачем нужна операция процессинга или «дозревания» мРНК? Зачем столько сложностей в резке и сшивке транслируемых и нетранслируемых областей в строгом порядке при формировании «стандартной» мРНК, пригодной для трансляции? А потом еще внимательно читать весь этот «мусор» при каждой трансляции, пусть «скольжением», но не пропуская же… , до самого конца цепочки мРНК. Зачем?
Зачем рибосома так старательно проходит всю мРНК от начала до конца во всех клетках?
Возможно, это действие закрепилось еще у прокариотов, где мРНК не имеет четкого деления на зоны НТО и зону трансляции. И чтобы не пропустить какую-то из зон трансляции рибосома вынуждена проходить весь путь по мРНК. Возможно…
Но, если рибосома или её малая субчастица как-то находит стартовый кодон трансляции, то как она это делает? Заранее «ловит» тРНК с пептидом МЕТ, а потом проверяет им всю цепь мРНК на совпадение «замочка и ключика»? Возможно…
А как же тогда понимать информационный контекст мРНК, при котором стартовый кодон по какой-то причине пропускается? Чем блокируется соединение «ключика» МЕТ с «замочком» на мРНК при показанном механизме поиска рибосомой стартового кодона? Контекстовый участок давно пройден, а рибосома помнит, что «это» было…, надо этот «старт» пропустить и продолжить поиск...
И наконец, самое главное: Триплетный счет на мРНК начинается только с началом трансляции белка. И заканчивается вместе с окончанием трансляции.
Вне этого процесса триплетный счет не работает. А какой работает?
Если учесть, что транслируемые области мРНК составляют менее половины её длины, то возникает вопрос: Что, как и чем считывается в нетранслируемых областях?
Как выясняется, трансляция белка является самым понятным и простым видом снятия информации с мРНК, но далеко не главным. Да, тут применяется триплетное считывание информации, но оказывается, это не основной вид считывания, а лишь один из видов, который основан на длине зоны взаимодействия кодонов тРНК с мРНК участка А и участка Р на малой субчастице рибосомы.
Говорить о всеобщем характере триплетного счета на мРНК и ДНК, по меньшей мере, рановато…
Да, а вопросов-то все больше и больше…
Литература:
- А. С. СПИРИН Биосинтез белка: элонгация полипептида и терминация трансляции http://nature.web.ru/db/msg.html?mid=1159501&uri=index.html
- А. С. СПИРИН. Биосинтез белка: инициация трансляции. http://nature.web.ru/db/msg.html?mid=1157659&uri=1.html
- А. С. СПИРИН Принципы функционирования рибосом http://nature.web.ru/db/msg.html?mid=1157658&uri=index.html
- А. С. СПИРИН. Принципы функционирования рибосом. Продолжение. ПРИНЦИП N 2: КОНФОРМАЦИОННАЯ ПОДВИЖНОСТЬ РИБОСОМЫ http://nature.web.ru/db/msg.html?mid=1157658&uri=1.html
- Никитин А.В., Считывание и обработка информации ДНК // «Академия Тринитаризма», М., Эл № 77-6567, публ.16147, 08.11.2010 http://trinitas.ru/rus/doc/0016/001c/00161718.htm
- Никитин А.В. Проблемы понимания системы кодирования ДНК. // «Академия Тринитаризма», М., Эл № 77-6567, публ.16181, 27.11.2010 http://trinitas.ru/rus/doc/0016/001c/00161731.htm
Никитин А.В., Работа рибосомы при трансляции белка // «Академия Тринитаризма», М.,
|
|